【健康】盘点未来国产新冠口服药
admin900 次
这两年疫情反复,导致不少疫情暴发地停工停产。除了继续坚持疫情防控,人们也把复工复产,恢复正常生活生产秩序的希望寄托在国产新冠治疗药物的面世上。其中,小分子口服药因可作用于病毒进入细胞内的各个环节,受变异株突变影响小,具有对变异株普遍有效的潜力,以及给药方便、生产储存运输成本低等优势,更是被寄予厚望。
目前,真实生物的阿兹夫定、君实生物的VV116,以及开拓药业的普克鲁胺都已完成了Ⅲ期临床试验,都有望冲击首款国产新冠小分子口服药。因此,不仅是上述三家公司在资本市场备受瞩目,与之签署了战略合作的其他公司,如海正药业、新华制药、奥联电子、华润双鹤等也颇受投资者热捧。
第一梯队:三剑客谁最强?
毋庸置疑,新冠小分子口服药已是继新冠疫苗之后又一个超级风口所在。全球目前已获批上市的两款新冠小分子口服药分别是默沙东的Molnupiravir、辉瑞的Paxlovid,其中Paxlovid已经临时纳入我国国内医保支付范围,售价为2300元/盒。据相关预测,全球口服新冠药物市场规模为数十亿至上百亿美元,折合人民币近千亿元。
在国内,新冠小分子口服药竞争更是进入白热化阶段,真实生物、君实生物和开拓药业这三家药企棋逢对手,均属新冠口服药研发第一梯队的它们,究竟谁能最终将首款国产新冠小分子口服药收入囊中?
阿兹夫定(真实生物)

阿兹夫定算是“老药”新用。它原是真实生物自主研发的抗艾滋病药物,于2021年7月获批上市用于治疗HIV。据悉,早在2020年2月,新冠疫情出现后不久,阿兹夫定就被发现可以抗新冠病毒;同年4月被NMPA批准抗新冠Ⅲ期临床试验。
在今年4月的中国医学发展大会上,中国医学科学院学部委员、中国工程院院士蒋建东发表了有关阿兹夫定临床研究成果的报告,称口服该药3-4天核酸转阴,平均用药时间6-7天,平均出院时间为9天,而且对重症与轻症患者的治疗效果相似,对使用其他药物无效的患者同样有效,并且不需要如Paxlovid那般必须在感染新冠的早期服用。
蒋建东还表示,目前,在中国、俄罗斯和巴西开展的Ⅲ期临床实验已经结束,俄罗斯和巴西结果已经报批。
据了解,真实生物目前已为阿兹夫定敲定了3家生产经销商,即新华制药、华润双鹤,以及奥翔药业。
VV116(君实生物)
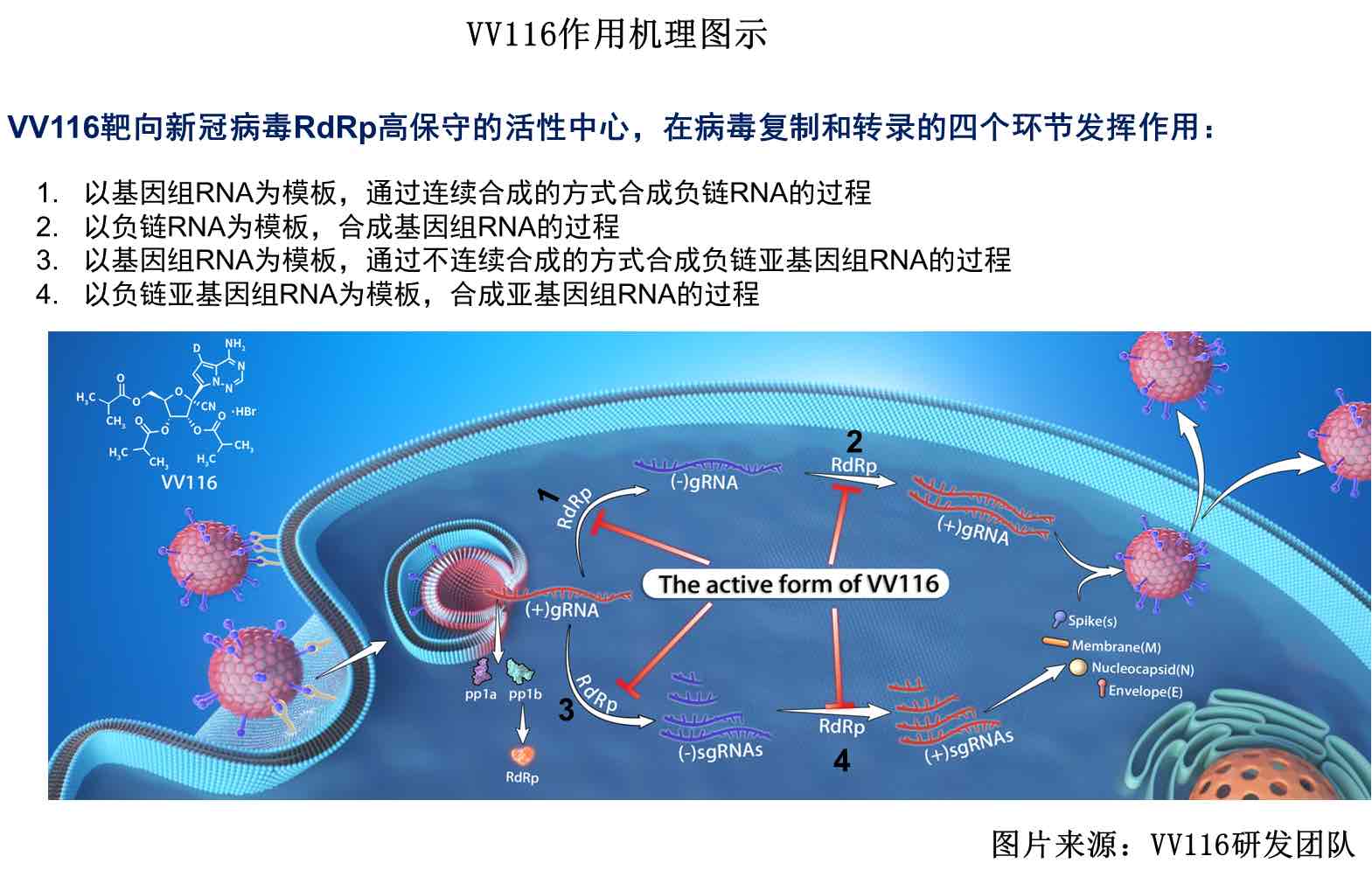
VV116是张江药企君实生物自主研发的一款针对新冠病毒的口服核苷类药物,已在乌兹别克斯坦获得批准用于中重度COVID-19患者的治疗。5月23日夜间,君实生物发布公告称VV116对比辉瑞PAXLOVID早期治疗轻中度COVID-19Ⅲ期注册临床研究已达到主要研究终点。
这项在瑞金医院进行的头对头临床试验,由上海交通大学医学院附属瑞金医院宁光院士担任主要研究者,实际入组822例患者,是一项多中心、单盲、随机、对照Ⅲ期临床研究,进展飞速,4月下旬开始,1个月内就已成功。但具体数据尚未披露。
君实生物公告称,将于近期与药物监管部门沟通递交新药上市申请事宜。虽然此次Ⅲ期大规模临床试验达到主要终点,但VV116最终是否获批还取决于监管部门对数据的分析,目前市场更加期待君实生物披露该临床的详细数据。
此前,VV116在中国奥密克戎感染受试者中的首个临床研究结果已于5月18日发表在《Emerging Microbes & Infections》杂志。该小样本量研究结果显示,VV116的转阴时间是8.56天。综合结果来看,略高于阿兹夫定3-4天的转阴时间。在药物安全性上,未观察到严重不良反应。
在进度上, VV116与阿兹夫定相近。5月20日,君实生物与海正药业签署了生产及市场开发等方面的战略协议。
普克鲁胺(开拓药业)
普克鲁胺是开拓药业自主研发的新一代雄激素受体(AR)拮抗剂,原用于前列腺癌、乳腺癌的临床研究。新冠疫情暴发后,研究发现其能降解ACE2(血管紧张素转换酶2)和TMPRSS2(跨膜蛋白酶丝氨酸2),阻止新冠病毒入侵宿主细胞,同时通过激活 Nrf2 通路抑制炎症因子产生,下调巨噬细胞中的 iNOS 抑制细胞因子风暴的发生,对于新冠轻中症、重症均有很好的效果。
2021年,美国食品药品监督管理局(FDA)及巴西国家卫生监督局(ANVISA)批准了普克鲁胺新冠适应症的Ⅲ期临床试验。之后,在巴西由研究者发起(IIT)的临床试验中,普克鲁胺对于轻中症新冠患者的保护率达90%以上,并将重症新冠患者的死亡风险降低78%。该数据一经披露,令全世界科学家为之一振,顶级学术期刊《Science》更点评其“好得难以置信”。
同年年底,由于新冠患者住院或死亡的事件数较少,普克鲁胺前述临床试验中期分析结果未达到预期。消息传出后,开拓药业当日总市值几乎蒸发了85%。但开拓药业之后仍按原方案继续完成临床试验。
2022年4月6日,开拓药业公布了普克鲁胺治疗轻中症的Ⅲ期全球多中心临床试验最终关键结果。数据显示,普克鲁胺有效降低新冠患者(主要受德尔塔和奥密克戎变异株感染)的住院/死亡率,特别是对于服药超过7天的全部患者,以及伴有高风险因素的中高年龄新冠患者达到100%保护率。
真可谓一波三折,但终归柳暗花明。在临床进度上,普克鲁胺快于阿兹夫定和VV116。据悉,就其新冠适应症,开拓药业与复星医药达成了在印度和28个非洲国家的商业化合作协议,与印度尼西亚公司Etana达成了在印度尼西亚的商业化合作协议。此外,还与上药控股、 京东大药房、国药集团达成了商业化合作。
第二梯队:能否后来居上?
2022开年以来,关于国产新冠小分子口服药的利好消息是一个接一个,除了前述第一梯队的三家药企,第二梯队的先声药业、科兴制药、亚盛医药、众生药业、歌礼制药、云顶新耀、绿叶制药、复宏汉霖、神州细胞等也正开足马力加速布局,努力实现技术突破,排队进入临床阶段。其中,先声药业的SIM0417先声夺人,5月底已完成Ⅰ期临床试验。
SIM0417(先声药业)
SIM0417是先声药业与中国科学院上海药物研究所、武汉病毒研究所合作开发的,其针对新冠病毒复制必需的关键蛋白酶3CL,在临床前动物模型上显示了良好的抗病毒活性和安全性,对包括德尔塔毒株在内的多种新冠变异毒株均有很强的抑制作用。
2022年5月16日,SIM0417获得国家药品监督管理局签发的药物临床试验批准通知书,拟用于曾暴露于新冠检测阳性感染者的密接人群的暴露后预防治疗,这也是国内首个获批的密接预防研究临床试验。
据悉,其受试者为48小时内接触了新冠感染者的高频密接者。用SIM0417探索新冠密接人群的预防,是其开发团队根据变异株新特征进行的差异化策略调整。奥密克戎毒株传播速度快、潜伏期短、隐匿性强,使得疫情暴发时大量密接人群对预防药物有着巨大的临床需求。
日前,先声药业负责人表示,SIM0417用于新冠感染者的Ⅰ期临床已在5月底前完成。
SHEN26(科兴制药)
SHEN26是一款新型冠状病毒聚合酶(RdRp)抑制剂,可以通过抑制病毒核酸合成达到抗病毒效果,该药由科兴制药与南方科技大学坪山生物医药研究院院长张绪穆教授、中山大学医学院郭德银教授合作开发。
据了解,SHEN26的机制与瑞德西韦类似,都通过人体代谢产物GS-441524来抑制病毒RdRp酶活性,终止病毒复制。但在抗病毒活性方面,SHEN26大大优于瑞德西韦。
由于GS-441524细胞穿透性较差,瑞德西韦对其进行了改造。
据悉,SHEN26已完成全部药学和非临床研究工作,但还未进入临床试验。6月5日晚间,科兴制药和信立泰双双宣布,就SHEN26的CDMO技术服务及委托生产签署了协议。不过也有业内人士称,双方签署协议后,前期信立泰的药物生产主要为其临床试验服务,量应该不会很大,SHEN26距离上市销售还有较远的路。
奥雷巴替尼(亚盛医药)
奥雷巴替尼是浦东创新药企亚盛医药自主开发的一款治疗白血病药物。此前已获批在中国上市,用于治疗任何酪氨酸激酶抑制剂(TKI)耐药的慢性髓细胞白血病成年患者。
近日,顶级期刊《EMBO Molecular Medicine》刊载的华盛顿大学福瑞德·哈金森癌症研究中心系统生物学家Taran Gujral团队的一篇研究文章揭示,奥雷巴替尼可高效抑制奥密克戎诱导的人外周血单核细胞中细胞因子风暴的产生,具有治疗新冠病毒肺炎尤其是中重度患者的潜力。
这篇题为《奥雷巴替尼抑制人外周血单核细胞中SARS-CoV-2-Omicron变种介导的细胞因子释放》的文章揭示了奥雷巴替尼在新冠治疗方面的潜力。
尽管目前感染奥密克戎的新冠患者症状很轻甚至无症状,但仍有部分患者会出现由大量细胞因子产生而引起的过度炎症,即“细胞因子风暴”,并最终导致肺泡损伤及呼吸衰竭。亚盛医药负责人表示,针对上述研究发现,公司计划尽快推向人体临床研究,目前正在与中国和美国的药监部门联系中。
该负责人还表示,不少新冠后遗症跟感染新冠后细胞因子风暴产生相关。从长远来讲,治疗新冠,除了要抑制病毒复制外,也要预防或者减少后遗症问题出现。因此加快开发新的治疗药物,以应对新冠肺炎所引发的并发症迫在眉睫。
RAY1216(众生药业)
RAY1216是众生药业子公司众生睿创自自主研发的广谱抗新冠病毒3CL蛋白酶抑制剂。5月16日,众生药业公告称,RAY1216药物临床试验已获国家药品监督管理局批准。
3CL蛋白酶切割位点在冠状病毒属“高度保守”区域,对冠状病毒的变异株保有高度活性,发生耐药几率较低。临床前研究表明,RAY1216对新冠病毒3CL蛋白酶具有显著的抑制作用,且对不同新冠病毒变异株(野生株、阿尔法、贝塔、德尔塔、奥密克戎)均有高效的体外抑制活性,抑制作用与辉瑞的Paxlovid相当。
摘要:盘点未来国产新冠口服药(2022年6月6日)
文/沈润秋
View Fullscreen
全球新冠治疗特效药盘点
1.瑞德西韦:全球头个新冠抗病毒药物
2020年4月底,瑞德西韦的三项试验数据同一天出炉,引起巨大轰动。两天后的5月1日,它就获得FDA紧急使用授权,用于治疗重症住院的疑似或经实验室确认的新冠成人和儿童患者。
参考FDA的这一授权,日本也于5月7日宣布瑞德西韦符合“特例审批制度”,可以正式在日本制造并贩卖。日本因此成为全球头个正式承认瑞德西韦贩卖与制造的国家。
直到2020年10月,美国FDA才正式批准瑞德西韦(商品名Veklury)上市,治疗12岁及以上、体重至少40公斤、需要住院治疗的新冠患者。而瑞德西韦也成为全球头个获批的新冠抗病毒药物。
2.莫纳皮拉韦:全球头个新冠口服药
在2021年逆转录病毒和机会性感染会议(CROI 2021)的Science Spotlights期间,默克公司和Ridgeback公司介绍,初步研究显示,在口服莫那皮纳伟的第5天,47位新冠病毒感染者全部转阴,有效率100%。
2021年11月4日,英国率先批准莫纳皮拉韦(Molnupiravir),用于18岁及以上新冠病毒检测结果呈阳性患者,并且至少有一个发展为重症风险的因素,如肥胖或心脏病。这是全球头个正式获批的新冠治疗口服药,患者在家中就可以服药接受治疗,为终结疫情增添了一种重要的新武器。
2021年12月,美国FDA授予莫纳皮拉韦紧急使用授权,而美国联邦政府也已签订合同,向默克公司采购了数百万疗程的药物。
3.Paxlovid:全球第二款新冠口服药
2021年12月14日,辉瑞公司表示,其新冠口服药Paxlovid,在防止高危病人住院和死亡方面有89%的效果。此外,单独的实验室测试表明,Paxlovid还保留了对新变异株奥密克戎的效力。
2021年12月22日,美国FDA紧急批准Paxlovid,用于12岁以上、体重40公斤以上、具有较高重症风险的轻中度新冠患者。紧接着,以色列和英国相关部门均在12月底发表声明,已批准Paxlovid的使用。
此外,据央视新闻报道,2022年1月2日,德国联邦卫生部长劳特巴赫宣布,德国联邦政府希望在1月份对Paxlovid进行紧急批准。
4.VV116:全球第三、国内首个新冠口服药
2021年12月30日,由中国企业研发的新冠口服药VV116,在乌兹别克斯坦获得紧急使用授权,成为继Molnupiravir、Paxlovid之后,全球第三款正式获批或获紧急使用授权的新冠口服药。
据媒体报道,VV116是由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心等共同研发。临床前药效学研究显示,VV116在体外对新冠病毒原始病毒株和变异株(如德尔塔病毒等),都有显著的抑制活性作用。
2021年11月2日,VV116在国内获得临床试验批准,也是国内目前仅有的一款获批临床试验的新冠治疗小分子药物,有望在2022年年内完成临床试验并申请上市。
结语
自新冠疫情爆发以来,世界各国的科学家们,一直在持续不断地研发对抗新冠病毒的手段和方法,截至目前,已有多种新冠疫苗、多款新冠治疗特效药在全球各地获批,给“终结”新冠疫情打下了坚实的基础。

评论 | 0 条评论